S. GENZOR
Klinika plicních nemocí a tuberkulózy, FN a LF Univerzity Palackého, Olomouc
___
Použití anticholinergik s dlouhodobým účinkem (long acting muscarinic antagonist – LAMA) je logickým krokem v léčbě nedostatečně kontrolovaného astmatu, v případě neúčinnosti léčby kombinací inhalačním kortikosteroidem (IKS) a inhalačním beta2-agonistou s dlouhodobým účinkem (long acting beta2-agonist – LABA). Jejich přidání může zlepšit kontrolu nad astmatem a snížit frekvenci exacerbací. Robustná data ohledně efektivity tiotropia v léčbě astmatu podporují myšlenku možného použití jiných LAMA v léčbě astmatu. Studie TRIMARAN, TRIGGER, IRIDIUM a ARGON zkoumaly účinnost glykopyrronia s kombinací IKS a LABA, studie CAPTAIN testovala použití umeklidinia. Všechny jmenované studie prokázaly, že i použití jiných LAMA, než tiotropia v léčbě astmatu je bezpečné a efektivní. Přidání LAMA do kombinace IKS/LABA dle studií TRIMARAN a TRIGGER snížilo frekvenci exacerbací a zlepšilo plicní funkce u sledovaných pacientů. Studie TRIGGER a ARGON prokázaly non-inferioritu fixní trojkombinace IKS/LAMA/LABA s použitím glykopyrronia ve srovnání s volnou kombinací obsahující tiotropium. Fixní trojkombinace může mít navíc potenciál ke zvýšení compliance pacientů.
Klíčová slova: těžké astma, LAMA, fixní trojkombinace
___
ÚVOD
Bronchiální astma je různorodé onemocnění charakterizované chronickým zánětem a remodelací průdušek, spojenými s jejich hyperreaktivitou a variabilní, často reverzibilní, obstrukcí. Projevuje se opakovanými stavy hvízdavého dýchání, kašlem, dušností a svíráním na hrudi (doporučený postup diagnostiky a léčby bronchiálního astmatu). V léčbě astmatu jsou na prvním místě inhalační kortikosteroidy (IKS), které jsou nejdůležitější pro udržení kontroly nad aktivitou onemocnění. V poslední době se do doporučených postupů dostává již v prvním kroku léčby astmatu kombinace s inhalačním beta2-agonistou s dlouhodobým účinkem (long acting beta2-agonist = LABA) [1,2]. Tato léčiva mají plný účinek po dobu 12 hodin, beta2-agonisté s účinkem 24 hodin jsou označována jako U-LABA (ultra-long acting beta2-agonist), neboli inhalační beta2-agonisté s ultra-dlouhodobým účinkem. Další kroky léčby se dle aktuálně platných doporučených postupů Globální iniciativy pro léčbu astmatu řídí tíží onemocnění a fenotypem astmatu. V léčbě těžkého astmatu mají svoje místo i inhalační anticholinergika s dlouhodobým účinkem (long acting muscarine antagonist = LAMA). Analogicky je v praxi používána i skupina inhalačních anticholinergik s ultra-dlouhodobým účinkem, tj. U-LAMA (ultra-long acting muscarine antagonist). Tyto jsou dle doporučení přidávány ke kombinaci IKS/LABA za účelem zlepšení ventilačních funkcí pacientů. Nejlepší evidence o účinnosti a bezpečnosti je v případě U-LAMA tiotropia [3]. V léčbě chronické obstrukční plicní nemoci (CHOPN) jsou běžně užívána další (U)-LAMA, jako je glykopyrronium, umeklidinium a aklidinium [4]. Ukazuje se, že i tyto léky mohou být potenciálně přínosné v léčbě astmatu. Navíc jsou již dostupné fixní kombinace některých LAMA s LABA a IKS. Tento přehledový článek se zabývá aktuálními možnostmi inhalační léčby těžkého astmatu se zaměřením na kombinační léčbu s použitím LAMA.
___
Cholinergní systém v etiopatogenezi astmatu
Je dobře zdokumentováno, že cholinergní systém se podílí na patogenezi asthma bronchiale. Bloudivý nerv (n. vagus) vede svá pregangliová parasympatická vlákna do peribronchiálních ganglií, kde pomocí cholinergních synapsí dochází k převodu signálu do postgangliových neuronů vedoucích vlákna, která inervují dýchací cesty. Aktivita parasympatického systému je mediována pomocí muskarinových receptorů; převážně se jedná o receptory typu M1, lokalizovaných na parasympatických gangliích. Receptory M2 se nacházejí v blízkosti postgangliových synapsí a zprostředkují negativní feedback, čímž redukují uvolňování acetylcholinu. Receptory M3 se nacházejí na hladké svalovině a submukózních žlázkách; jejichž stimulací se zvyšuje tonus bronchiální svaloviny a zvyšuje sekrece hlenů [5].
Předpokládaných příčin zvýšené aktivity parasympatiku u astmatiků je několik: zvýšená exprese muskarinových receptorů, zvýšená koncentrace acetylcholinu na postgangliových synapsích a snížení koncentrace neuromodulátorů, snižujících cholinergní neurotransmisi. Typickou ukázkou této cholinergní hypersenzitivity je bronchiální hyperreaktivita na cholinergní analoga při bronchokonstrikčním testu (nejčastěji metacholin) [6]. Acetylcholin je produkován dále i epitelem dýchacích cest a dalších buněk jiného než neuroepitelového původu (např. eozinofily a mastocyty). V těchto případech lze mluvit o parakrinním či autokrinním účinku tohoto působku (v anglosaské literatuře tzv. non-neurogenic acetylcholine) [7].
Anticholinergní léky výše popsané procesy blokují. Jejich nejstarší zástupce – atropin – má účinky bronchodilatační, snižuje sekreci hlenů a snižuje bronchiální hyperreaktivitu [6]. Pro četné nežádoucí účinky se nyní v klinické praxi nevyužívá. Krátkodobě působící anticholinergika jsou používaná již od roku 1975, jejich efekt však trvá jen několik málo hodin [8]. Namísto toho byla vyvinuta inhalační anticholinergika s dlouhodobým účinkem, která mají velmi dobrý bezpečnostní profil.
Dalším argumentem ve prospěch použití LAMA v léčbě astmatu jsou příznivé lékové interakce mezi LAMA, IKS a LABA. In vitro byly popsány synergické efekty beklometasonu a glykopyrronia – snížení M2 a M3 aktivity hladké svaloviny dýchacích cest [9]. Velmi silný synergistický efekt byl popsán rovněž v případě kombinace beklometason dipropionát + formoterol furoát + glykopyrronium (BDP/FF/Gly). Byla popsána aktivace intracelulárního glukokortikoidového receptoru a Gsα podjednotky G proteinu beta2-receptorů [10]. U LAMA bylo dále popsáno snížení hladiny interleukinu-4 produkovaného zejména bazofily, které vedlo nepřímo ke snížení eozinofilního zánětu [11]. Synergický účinek duální bronchodilatační léčby spočívá v ovlivnění tonu hladké svaloviny průdušek současnou stimulací beta2-receptorů a blokací M3 receptorů. Současně dochází ke vzájemnému ovlivnění intracelulárních signálních drah, a to zejména na úrovni vápníkem aktivovaných draslíkových kanálech a tyrozin kináz [12].
___
Tiotropium
Tiotropium jako významný zástupce U-LAMA byl společně s celou lékovou skupinou iniciálně vyvinut k léčbě CHOPN. Je podáván inhalačně, vzhledem k dlouhému biologickému poločasu 1x denně, maximální bronchodilatační účinek je patrný za 3 hodiny [13]. Oproti ipratropiu má vyšší selektivitu k M3 receptorům a výrazně delší účinek [14].
Mangussen et al. [15] provedli randomizovanou studii na 472 pacientech s překryvným syndromem obstrukční plicní nemoci a astmatu. Tiotropium bylo u těchto pacientů přidáno do terapie k IKS (minimálně 1 rok užívání před zahájením studie). Autoři pozorovali zlepšení plicních funkcí a redukci používání úlevové medikace.
Peters et al. [16] publikovali studii na 210 pacientech s nedostatečnou kontrolou astmatu při užívání nízké dávky IKS (80 µg BDP 2x denně). Přidání tiotropia bylo v této práci superiorní ve srovnání s navýšením dávky BDP (160 µg 2x denně). Kombinace LAMA/IKS byla v této studii non-inferiorní k IKS/LABA (dle hodnoty FEV1 před podáním léků). Studie nehodnotila kombinaci IKS/LABA/LAMA. V následujících letech se objevil velký počet studií hodnotících efekt právě této kombinace ve srovnání s IKS/LABA a vznikaly četné metaanalýzy a systematické review, hodnotící význam těchto výsledků. Kertsjens et al. [17] ve studii PrimoTinA prokázal efekt přidání tiotropia do kombinace IKS/LABA (800 µg budesonidu anebo jeho ekvivalent + LABA) ve snížení rizika exacerbace u pacientů s těžkým bronchiálním astmatem až o 21 % a nárůstu průměrné hodnoty FEV1 o 99 ml (celkem 912 pacientů). V navazující studii MezzoTinA [18] byla prokázána non-inferiorita tiotropia ve srovnání se salmeterolem v kombinaci s IKS. Studie měla 4 ramena: IKS (400-800 µg budesonid/ekvivalent) + tiotropium 2,5 µg – 1x denně; IKS + tiotropium 5µg – 1x denně; IKS + salmeterol 50 µg 2xdenně; placebo + IKS). Navýšení průměrné hodnoty FEV1 bylo v této studii při obou dávkách tiotropia signifikantně vyšší ve srovnání s terapií IKS + placebo (+140 ml pro tiotropium 5 µg; + 180 ml pro tiotropium 2,5 µg a + 114 ml pro salmeterol). Žádné závažné nežádoucí účinky nebyly detekovány. Výsledky potvrdila i systematická review Kew et al. [19], která prokázala význam přidání U-LAMA do kombinace IKS/LABA, zejména v redukci užívání systémových steroidů a záchranné medikace.
___
Glykopyrronium
Glykopyrronium (Gly) je další z inhalačních dlouhodobě působících anticholinergik. Zajímavostí je, že inhalační použití nebylo původně u tohoto léku zamýšleno. První klinické zkušenosti s Gly jsou z šedesátých let minulého století, kdy se používal v léčbě vředové choroby, či v případě hyperhidrózy a nadměrné salivace [20]. V případě astmatu byla první studie, ovšem jen na několika málo pacientech, publikovaná v roce 1987 [21], kdy byl prokázán dvanáctihodinový bronchodilatační účinek. V inhalační formě získalo Gly v Evropské unii registraci pro léčbu CHOPN až v roce 2012. Oproti tiotropiu má rychlejší nástup účinku – plný bronchodilatační efekt lze očekávat již za 5–15 minut, účinek trvá dle dávky 12–24 hodin; při dávce 18 mcg, která se využívá v léčbě astmatu, je patrný plný účinek po dobu 12 hodin (v této dávce tedy patří mezi LAMA). Dávka více než 40 mcg již udrží plný účinek 24 hodin a v tomto dávkování se dosud využívá zejména v léčbě CHOPN (a lze jej v této indikaci řadit mezi U-LAMA).
___
Použití glykopyrronia ve fixní kombinaci s IKS a LABA
Studie TRIMARAN a TRIGGER [22] zkoumaly efektivitu a bezpečnost fixní trojkombinace extrafine BDP/FF/Gly v léčbě astmatu. Jednalo se o klinické studie III. fáze klinického testování. TRIMARAN srovnával středně vysokou dávku IKS (2x denně fixní kombinace – 100 µg BDP + 6 µg FF + 10 µg Gly) u pacientů s nekontrolovaným astmatem (n = 1 155). Vstupní kritéria obou studií byly pre-bronchodilatační hodnota FEV1 méně než 80 % náležitých hodnot, reverzibilita obstrukce při bronchodilatačním testu salbutamolem o více než 12 % a současně 200 ml FEV1, nedostatečně kontrolované astma a 1 a více akutních exacerbací v předchozím roce (vyžadující použití systémových kortikosteroidů či vyšetření na oddělení urgentního příjmu anebo hospitalizaci). Vedlejší cíle studie byly pre-bronchodilatační hodnota FEV1 (týden 26) a počet středně těžkých a těžkých exacerbací za 52 týdnů sledování. Před začátkem studie byly všichni pacienti léčeni 2 týdny kombinací BDP+FF, poté již byly rozděleni dle randomizace do jednotlivých ramen. Studie TRIGGER měla podobný design, ale použitá dávka IKS byla vysoká (200 µg BDP + 6 µg FF + 10 µg Gly) (n = 1437). Tato studie navíc ještě zahrnovala rameno s kombinací 100 µg BDP/ 6 µg FF (fixně) + 5 µg tiotropia. Obě studie byly prospektivní, randomizované a multicentrické. Zásadní závěr obou studií je, že fixní trojkombinace BDP/FF/Gly signifikantně snižuje četnost středně těžkých a těžkých exacerbací (o 15 % ve studii TRIMARAN). Ve studii TRIGGER bylo zaznamenáno snížení četnosti těžkých exacerbací o 23 % (p=0,008). Předléková hodnota FEV1 byla v rameni s BDP/FF/Gly ve 26. týdnu sledování signifikantně vyšší ve srovnání s BDP/FF (+57 ml – TRIMARAN, p = 0,008; + 73ml – TRIGGER, p = 0,0025). Nebyly zaznamenány žádné rozdíly ve výskytu závažných nežádoucích účinků. Ve studii TRIGGER rovněž nebyly prokázané signifikantní rozdíly mezi kombinací BDP/FF/Gly a BDP/FF + tiotropium, a to jak ve smyslu zlepšení plicních funkcí a četnosti akutních exacerbací, tak i ve frekvenci nežádoucích účinků. Primární výsledky studií TRIMARAN a TRIGGER zobrazuje obrázek 1.
___
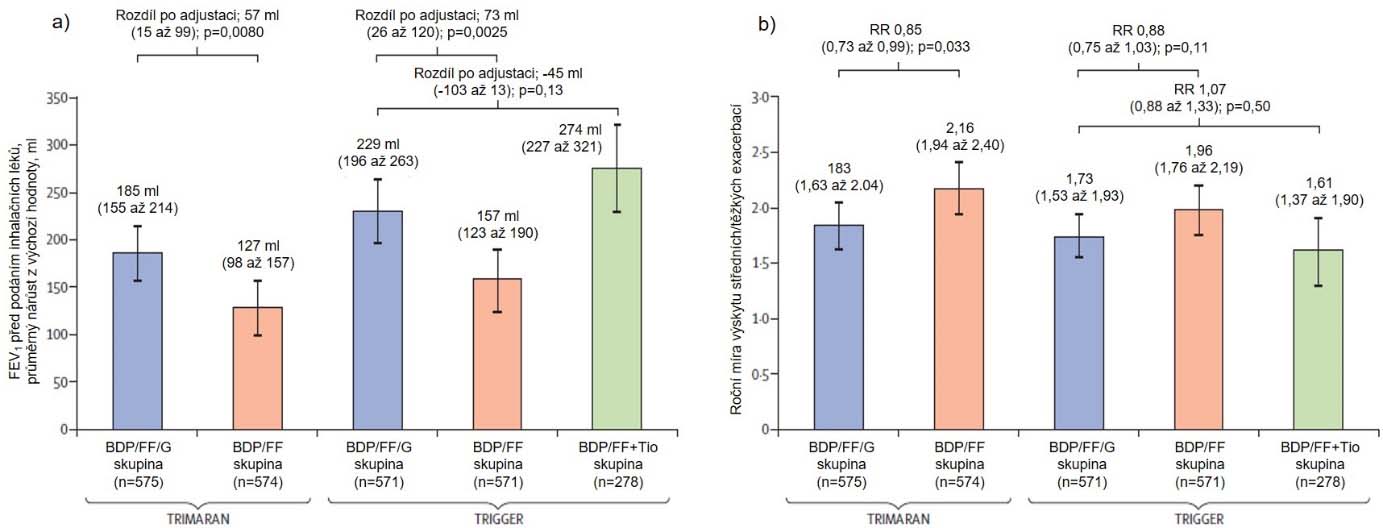
Obrázek 1: Primární cíle studií TRIMARAN a TRIGGER a jejich výsledky
a) Nárůst hodnoty FEV1 dle jednotlivých skupin; FEV1 = forced expiratory volume 1 s
b) Roční míra výskytu středních/těžkých exacerbací; RR = rate ratio (poměr výskytu mezi jednotlivými skupinami dle terapie) po adjustaci.
___
Studie IRIDIUM (n = 3092) [23] zkoumala efekt fixní trojkombinace mometason furoátu (MF)/indakaterolu (IND) a GLY ve srovnání s kombinací MF/IND a flutikazon/salmeterol. Pacienti ve studii měli nedostatečně kontrolované astma. Vstupní kritéria studie byly analogické s předchozími studiemi, stejně tak i cíle studie. Jak střední, tak i vysoká dávka MF ve fixní kombinaci s IND/GLY ve srovnání s flutikazon/salmeterol prokázala signifikantní redukci počtu středně těžkých (19 %, p = 0,041 a těžkých exacerbací (36 %; p <0,001). V počtu exacerbací nebyly signifikantní rozdíly mezi skupinou s MF/IND a MF/IND/GLY.
Analogicky se studií TRIGGER, studie ARGON [24] prokázala non-inferioritu fixní kombinace MF/IND/GLY ve srovnání flutikazon/salmeterol + tiotropium ve volné kombinaci.
Další LAMA v léčbě astmatu umeklidinium, aklidinium
Studie CAPTAIN [25] (n = 2439) srovnávala fixní kombinaci flutikazon/umeklidinium/vilanterol (Flu/Umec/Vil) s Flu/Vil u pacientů s nekontrolovaným středně těžkým a těžkým astmatem. Použita byla středně vysoká a vysoká dávka IKS (100-200 µg Flu). Fixní trojkombinace ve srovnání s IKS/LABA vedla ke zlepšení plicních funkcí ve 24. týdnu, ale nebyl prokázán signifikantní pokles počtu exacerbací. Ke snížení počtu exacerbací byla klíčová dávka IKS, kdy vysoká dávka IKS byla spojena s redukcí rizika exacerbace. Tento efekt byl patrný zejména v podskupině pacientů se zvýšeným počtem eozinofilů a zvýšenou koncentrací oxidu dusnatého ve vydechovaném vzduchu.
Aklidinium zatím nemá dostupné klinické studie na lidech, které by sledovaly jeho účinek v případě léčby astmatu. Vzhledem k průkazům jeho účinnosti v experimentálních modelech však lze očekávat i jeho účinnost. Milara et al. [26] prokázali in vitro inhibici transformace fibroblastu na myofibroblast u lidských buněčných linií (předpoklad snížení bronchiální remodelace u astmatu). Navíc Damera et al. [27] potvrdili na myším modelu u aklidinia snížení bronchiální hyperreaktivity a eozinofilie.
___
Skupiny pacientů s větší pravděpodobností dobrého efektu LAMA
Mezi možné skupiny astmatiků se zvýšenou pravděpodobností příznivé klinické odpovědi na terapii LAMA patří: pacienti s astmatem s fixovanou obstrukcí, s nočními projevy, s překrývajícím syndromem astma/CHOPN, (ex)kuřáci a podle některých autorů i pacienti s postižením periferních dýchacích cest.
Post-hoc analýza studií TRIMARAN a TRIGGER [28] identifikovala minimálně dvě skupiny pacientů, které z přidání LAMA do kombinace IKS/LABA profitovaly. Jednalo se zejména o pacienty s fixovanou bronchiální obstrukcí a o pacienty s výraznější postbronchodilatační reverzibilitou bronchiální obstrukce. Tyto zjištění mohou vyznívat kontradiktorně a paradoxně, ale jsou k tomu etiopatogenetické důvody. Skupina pacientů s větší reverzibilitou bronchiální obstrukce měla vyšší markery eozinofilního zánětu. Post-hoc analýza dokumentovala snížení frekvence exacerbací i pokles FeNO. Zde se můžou uplatnit příznivé lékové interakce kombinace IKS/LAMA/LABA i samotná aktivita LAMA v potlačení eozinofilního zánětu. Druhá skupina s výraznějším benefitem z fixní trojkombinace IKS/LABA/LAMA – pacienti s fixovanou bronchiální obstrukcí měli signifikantně výraznější snížení počtu akutních exacerbací (obrázek 2) i výraznější zlepšení plicních funkcí. U této skupiny pacientů byl prokázán pokles frekvence exacerbací bez ohledu na roční období.
___
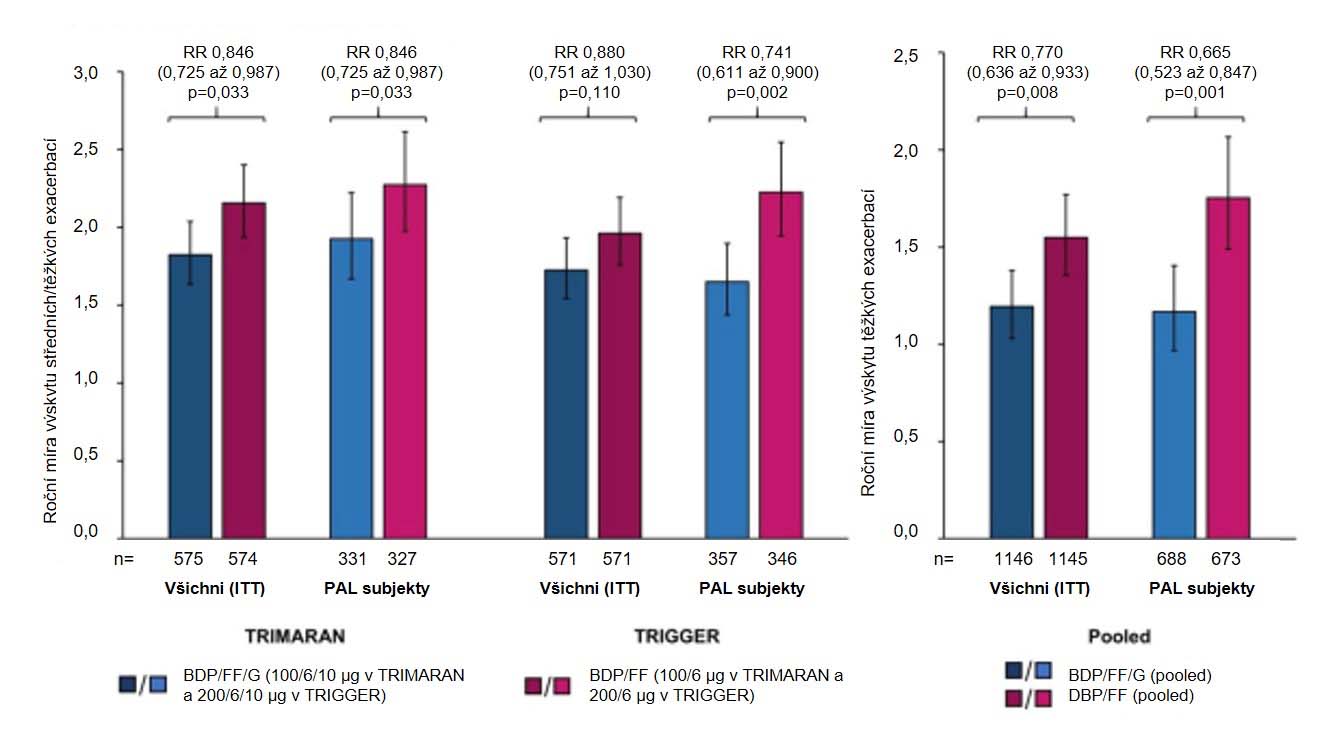
Obrázek 2: Výsledky post-hoc analýzy studií TRIMARAN a TRIGGER – u pacientů s fixovanou bronchiální obstrukcí (persistant airflow limitation = PAL) je signifikantně výraznější redukce počtu exacerbací. RR = rate ratio (poměr výskytu mezi jednotlivými skupinami dle terapie).
___
Jelikož LAMA je léková skupina původně určená k terapii CHOPN, lze jistě očekávat dobrou účinnost také u pacientů s překryvným syndromem astma/CHOPN [29]. Příčinou může být časté kouření u této skupiny astmatiků. Na základě dat z myšího modelu [30] se lze domnívat, že účinky kouření kromě zvýšeného neutrofilního zánětu zahrnují i aktivaci cholinergního systému (nikotinem), a to dominantně přes M3 receptory. Sprio et al. [31] ve své observační studii na 521 pacientech s astmatem prokazují význam LAMA, zejména v terapii pacientů s historií kuřáctví 10 a více balíčkoroků.
Noční projevy astmatu jsou u pacientů s těžkým astmatem poměrně časté. Větší aktivita parasympatického nervového systému v nočních hodinách je považována za jednu z příčin nočních projevů u astmatiků. Podle Skloota [32] má tato skupina pacientů zvýšenou pravděpodobnost pozitivní odpovědi na LAMA.
Postižení periferních dýchacích cest, v anglosaské literatuře často pod názvem small airway disease, je specifický fenotyp postižení u bronchiálního astmatu. Tato skupina pacientů může být značně symptomatická, přičemž ovlivnění klinických projevů je často obtížné. Navíc prevalence small airway disease u pacientů s asthma bronchiale dosahuje 26 % (u pacientů skupiny GINA 1) až 72 % (GINA 5) [33]. Při hodnocení pomocí oscilometrie je prevalence ještě vyšší – 54 % u GINA1 a až 91 % u GINA 5. Lipworth et al. [34] u této skupiny pacientů doporučují preferenční podávání inhalačních preparátů s extrafine velikostí částic (vzhledem k potřebě distribuce léčiva do periferie dýchacích cest).
Používání jednoho inhalátoru namísto dvou, anebo tří léčebný režim zjednodušuje. V případě CHOPN bylo prokázáno zlepšení compliance u pacientů na fixní trojkombinaci, což se promítlo v lepší účinnosti léčby v klinické praxi [35]. Přesto, že data o compliance při použití fixní trojkombinace u astmatiků zatím nejsou k dispozici, se lze domnívat, že zde může být analogie.
___
ZÁVĚR
LAMA představují léčebnou modalitu, která může zlepšit kontrolu nad astmatem a snížit frekvenci exacerbací. Kromě již zavedeného tiotropia budou v blízké budoucnosti dostupné preparáty s jinými účinnými látkami – glykopyrronium a umeklidinium. Tyto látky, které zatím nejsou konvenčně v léčbě astmatu používané, jsou navíc dostupné ve fixní kombinaci s LABA a IKS. V případě středně těžkého a těžkého astmatu je léčba fixní trojkombinací vysoce efektivní, jak prokazují studie TRIMARAN, TRIGGER, IRIDIUM, ARGON a CAPTAIN. Specifická skupina pacientů, u které lze očekávat dobrý efekt léčby, je astma s fixovanou obstrukcí, dále pacienti s nočními projevy astmatu, (ex)kuřáci a pacienti s postižením periferních dýchacích cest. V poslední jmenované skupině, která je navíc v případě astmatu vysoce prevalentní, je velmi výhodné použití extrafine velikosti částic. Fixní trojkombinace může mít navíc potenciál ke zvýšení compliance pacientů. Léčba astmatu u každého pacienta má vést na prvním místě ke zvýšení kvality života. Musí být cílena na potřeby jednotlivých pacientů.
___
LITERATURA
Teřl M, Čáp P, Dvořáková R et al. Doporučený postup diagnostiky a léčby bronchiálního astmatu. Dostupné online na: http://www.pneumologie.cz/guidelines
Global strategy for asthma management and prevention. Dostupné online na: 2020. https://ginasthma.org/
Papi A, Fabbri LM, Kerstjens HA et al. Inhaled long-acting muscarinic antagonists in asthma – A narrative review. Eur J Intern Med 2021; 85:14-22.
Lipari M, Kale-Pradhan PB, Wilhelm SM. Dual – Versus Mono – Bronchodilator Therapy in Moderate to Severe COPD: A Meta-analysis. Ann Pharmacother 2020; 54(12):1232-1242.
Satia I, Nagashima A, Usmani OS. Exploring the role of nerves in asthma; insights from the study of cough. Biochem Pharmacol 2020; 179:113901.
Bossé Y, Chin LYM, Paré PD et al. Adaptation of airway smooth muscle to basal tone relevance to airway hyperresponsiveness. Am J Respir Cell Mol Biol 2009; 40:13-18.
Cazzola M, Puxeddu E, Matera MG et al. A potential role of tripple therapy for asthma patients. Expert Rev Respir Med 2019; 13:1079-1085.
Petrie GR, Palmer KNV. Comparison of aerosol iptratropium bromide and salbutamol in chronic bronchitis and asthma. Br Med J 1975; 1:430-432.
Cazzola M, Calzetta L, Rogliani P et al. Interaction between corticosteroids and muscarinic antagonists in human Airways. Pulm Pharmacol Ther 2016; 36:1-9.
Rogliani P, Matera MG, Facciolo F et al. Beclomethasone dipropionate, formoterol fumarate and glycopyrronium bromide: synergy of triple combination therapy on human airway smooth muscle ex vivo. Br J Pharmacol 2020; 177:1150-1163.
Matsuyama, T, Machida, K, Motomura, Y et al. Long‐acting muscarinic antagonist regulates group 2 innate lymphoid cell‐dependent airway eosinophilic inflammation. Allergy 2021; E-pub ahead of print, doi:10.1111/all.14836
Calzetta L, Matera MG, Cazzola M. Pharmacological mechanisms leading to synergy in fixed-dose dual bronchodilator therapy. Curr Opin Pharmacol 2018; 40:95-103.
Hohlfeld J, Sharma A, van Noord J et al. Pharmacokinetics and pharmacodynamics of tiotropium solution and tiotropium powder in chronic obstructive pulmonary disease. The Journal of Clinical Pharmacology 2014; 54:405-414.
Moulton BC, Fryer AD. Muscarinic receptor antagonists, from folklore to pharmacology; finding drugs that actually work in asthma and COPD. Br J Pharmacol 2011; 163(1):44-52.
Magnussen H, Bugnas B, van Noord J et al. Improvements with tiotropium in COPD patients with concomitant asthma. Respir Med 2008; 102(1):50-56.
Peters SP, Kunselman SJ, Icitovic N et al. National Heart, Lung, and Blood Institute Asthma Clinical Research Network. Tiotropium bromide step-up therapy for adults with uncontrolled asthma. N Engl J Med 2010; 363(18):1715-1726.
Kerstjens HAM, Engel M, Dahl R et al. Tiotropium in asthma poorly controlled with standard combination therapy. N Engl J Med 2012; 367:1198-1207.
Kerstjens HAM, Casale TB, Bleecker ER et al. Tiotropium or salmeterol as add-on therapy to inhaled corticosteroids for patients with moderate symptomatic asthma: two replicate, double-blind placebo-controlled, parallel-group, active-comparator, randomised trials. Lancet Respir Med 2015; 3:367-376.
Kew KM, Dahri K. Long-acting muscarinic antagonists (LAMA) added to combination long-acting beta2-agonists and inhaled corticosteroids (LABA/ICS) versus LABA/ICS for adults with asthma. Cochrane Database Syst Rev 2016; 1:CD011721.
Kaye MD, Beck P, Rhodes J, Sweetnam PM. Gastric acid secretion in patients with duodenal ulcer treated for one year with anticholinergic drugs. Gut 1969; 10(10):774-778.
Walker FB 4th, Kaiser DL, Kowal MB, Suratt PM. Prolonged effect of inhaled glycopyrrolate in asthma. Chest 1987; 91(1):49-51.
Virchow JC, Kuna P, Paggiaro P et al. Single inhaler extrafine triple therapy in uncontrolled asthma (TRIMARAN and TRIGGER): two double-blind, parallel-group, randomised, controlled phase 3 trials. Lancet 2019; 394(10210):1737-1749.
Kerstjens HAM, Maspero J, Chapman KR et al. IRIDIUM trial investigators. Once-daily, single-inhaler mometasone-indacaterol-glycopyrronium versus mometasone-indacaterol or twice-daily fluticasone-salmeterol in patients with inadequately controlled asthma (IRIDIUM): a randomised, double-blind, controlled phase 3 study. Lancet Respir Med 2020; 8(10):1000-1012.
Gessner C, Kornmann O, Maspero J et al. Fixed-dose combination of indacaterol/glycopyrronium/mometasone furoate once-daily versus salmeterol/fluticasone twice-daily plus tiotropium once-daily in patients with uncontrolled asthma: A randomised, Phase IIIb, non-inferiority study (ARGON). Respiratory Medicine 2020; 175:106186.
Lee LA, Bailes Z, Barnes N et al. Efficacy and safety of once-daily single-inhaler triple therapy (FF/UMEC/VI) versus FF/VI in patients with inadequately controlled asthma (CAPTAIN): a double-blind, randomised, phase 3A trial. Lancet Respir Med 2021; 9(1):69-84.
Milara J, Serrano A, Peiró T et al. Aclidinium inhibits human lung fibroblast to myofibroblast transition. Thorax 2012; 67:229-237.
Damera G, Jiang M, Zhao H et al. Aclidinium bromide abrogates allergen-induced hyperresponsiveness and reduces eosinophilia in murine model of airway inflammation. Eur J Pharmacol 2010; 649(1-3):349-53.
Singh D, Virchow JC, Canonica GW et al. Determinants of response to inhaled extrafine triple therapy in asthma: analyses of TRIMARAN and TRIGGER. Respir Res 2020; 21(1):285.
Ding B, Small M. Treatment trends in patients with asthma-COPD overlap syndrome in a COPD cohort: findings from a real-world survey. Int J Chron Obstruct Pulmon Dis 2017; 12:1753-1763.
Kistemaker LE, Bos IS, Hylkema MN et al. Muscarinic receptor subtype-specific effects on cigarette smoke-induced inflammation in mice. Eur Respir J 2013; 42(6):1677-1688.
Sprio AE, Ciprandi G, Riccardi E et al. The influence of smoking on asthma in the real-life. Respir Med 2020; 170:106066.
Skloot GS. Nocturnal asthma: mechanisms and management. Mt Sinai J Med 2002; 69(3):140-147.
Postma DS, Brightling C, Baldi S et al. Exploring the relevance and extent of small airways dysfunction in asthma (ATLANTIS): baseline data from a prospective cohort study. Lancet Respir Med 2019; 7(5):402-416.
Lipworth B, Manoharan A, Anderson W. Unlocking the quiet zone: the small airway asthma phenotype. Lancet Respir Med 2014; 2(6):497-506.
Halpin DM, Worsley S, Ismaila AS et al. INTERPRID: Clinical effectiveness of once-daily single-inhaler fluticasone furoate/umeclidinium/vilanterol versus multiple-inhaler therapy in usual clinical practice. Am J Respir Crit Care Med 2020; 201:A4313.
Došlo: 28. 4. 2021
Adresa:
MUDr. Samuel Genzor
Klinika plicních nemocí a tuberkulózy
FN a LF Univerzity Palackého Olomouc
I. P. Pavlova 6
779 00 Olomouc
Česká republika
e-mail: samuel.genzor@fnol.cz
Uveřejněno v časopise Studia pneumologica et phthieologica.
Zdroj: S t u d . P n e u m o l . P h t h i s e o l . , 8 1 , 2 0 2 1 , č . 3 , s . 1 0 6 – 1 1 1
Zdroj: S t u d . P n e u m o l . P h t h i s e o l . , 8 1 , 2 0 2 1 , č . 3 , s . 1 0 6 – 1 1 1



